
?
正成電解蝕刻機工作原理
解蝕刻工藝原理:(以鐵板在NaCL溶液中的正常電解蝕刻為例)
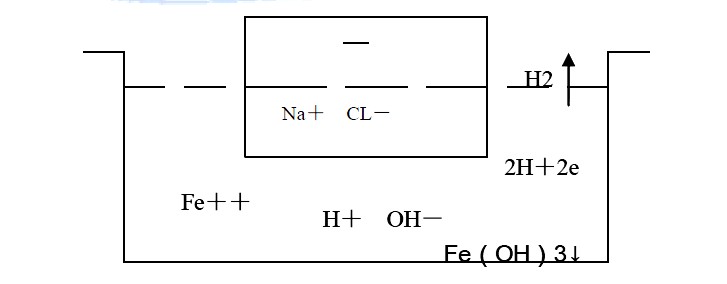
? 陽極反應
Fe—2e ——Fe+2
? Fe—3e—— Fe+3
? 4OH-—4e ——O2↑+2H2O
? 2CL- CL2
? Fe+2+2OH- ——Fe(OH)2↓ (墨綠色的絮狀物)
? 4Fe(OH)2+2H2O+O2 ——4Fe(OH)3↓ (紅褐色沉淀,鐵泥)
? 陰極反應 按反應可能性
? 2H++2e ——H2↑
? 按照電極反應的基本原理,電極電位最正的粒子將首先在陰極反應。因此,在陰極上只會析出氫氣,而不可能沉淀出鈉。
? 電解蝕刻過程中,由于水的分解消耗,電解液的濃度逐漸變大,而電解液中的Cl-和Na+僅起導電作用,本身并不消耗,因此對于NaCl電解液,只要過濾干凈,適當添加水分,就可長期使用。
?
Copyright @ 2015 常州正成機電科技有限公司版權所有????????????蘇ICP備11083325號







